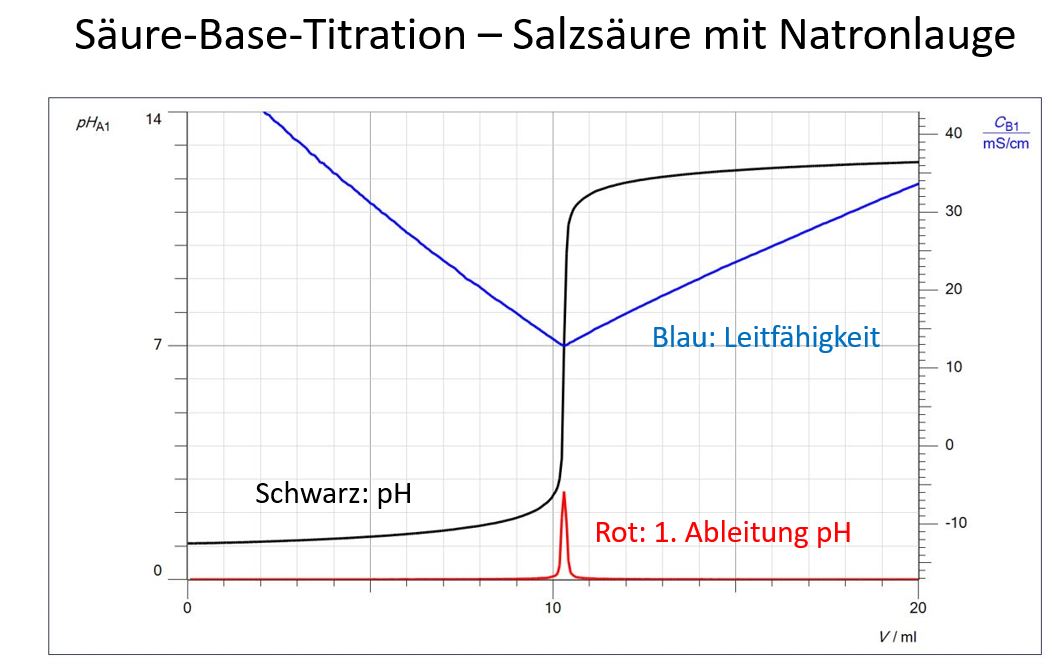
Die Messdaten einer Säure-Base-Titration lassen sich in CASSY-Lab 2 vielfältig bearbeiten und sind so einer bloßen Abbildung einer Titrationskurve weit überlegen. Die Auswertung lässt sich direkt in CASSY Lab 2 durchführen, das Messwerterfassungsprogramm kann aber auch dazu verwendet werden, Diagramme für eine Power-Point-Präsentation zu liefern, mit deren Screenshots die nachfolgenden Bilder erstellt wurden.
Wer die Auswertung selber durchführen möchte, kann sich, nach dem Herunterladen von CASSY Lab 2, die Orginaldatei der hier beschriebenen Titration herunterladen. CASSY Lab 2 kann ohne Lizenz zum Auswerten von Dateien verwendet werden, nicht allerdings zum Messen.
Link zum CASSY-Lab Download
CASSY Lab Datei: Titration von Salzsäure mit Natronlauge
Versuch: Titration von Salzsäure mit Natronlauge
Am Beispiel einer Säure-Base-Titration, bei der Leifähigkeit und pH gleichzeitig erfasst wurden, soll die Auswertung beispielhaft aufgezeigt werden. 10 ml Salzsäure, 1 mol/l, wurden auf 100 ml mit dest. Wasser verdünnt und mit Natronlauge, 1 mol/l, titriert.
Die Volumenbestimmung erfolgte mit Hilfe einer Waage, bei der die Masse über die Rechnerfunktion von CASSY Lab 2 in das Volumen umgerechnet wurde.
Um genügend Platz für die Elektroden zu haben, wurde in einem Weithals-Becherglas, 400 ml, gearbeitet.
Der Vorteil von Zweikanalmessungen
Titrationskurven sind leichter zu verstehen, wenn man pH und Leitfähigkeit zusammen auswerten kann. Das Denken in Logarithmen fällt Schülern in der Mehrzahl schwer, so dass vorgeschlagen wird, zuerst die Leitfähigkeits-Kurve auszuwerten. Natürlich beeindruckt auch die Tatsache, dass mit zwei verschiedenen Methoden das selbe Ergebnis erreicht wird, den Endpunkt einer Titration zu bestimmen.
Im Programm CASSY-Lab 2 können problemlos Mehrkanalmessungen durchgeführt, nach der Messung als Einzelmessung dargestellt und mit Auswerteoptionen versehen werden.
Die Leitfähigkeits-Kurve
Bei der Leitfähigkeit werden alle Ionen erfasst, allerdings sind Ionen unterschiedlich leitfähig:
Leitfähigkeit: H3O+ > OH– >> Na+ oder Cl–
Bei einer Leitfähigkeitstitration bleibt die Anzahl der Ionen immer konstant, aufgrund der unterschiedlichen Leitfähigkeit der Ionen kommt es zu einem charakteristischen Verlauf der Kurve.
Charakteristisch für eine Leitfähigkeits-Kurve, bei der eine starke Säure mit einer starken Base titriert wird, ist ein V-förmiger Kurvenverlauf mit einem scharfen Umschlag am Äquivalenzpunkt. Dabei fällt die Leitfähigkeit nicht auf Null ab, da am Äquivalenzpunkt noch Salzionen vorliegen, in unserem Fall gelöstes Natriumchlorid.
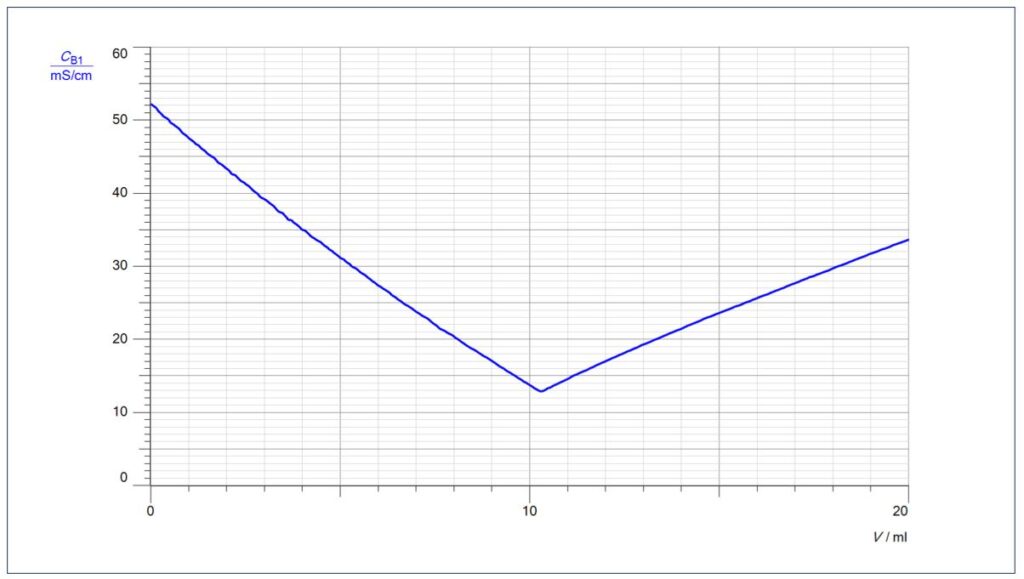
Warum kommt es zuerst zu einem Abfall der Leitfähigkeit: Für jedes Oxonium-Ion, das durch ein Hydroxid-Ion neutralisiert wird, wird kommt durch Zugabe von Natronlauge auch ein Natrium-Ion dazu. Natrium-Ionen haben aber eine sehr viel geringe Leitfähigkeit als Oxonium-Ionen.
Auffällig ist auch die geringere Steigung der Kurve nach dem Äquivalenzpunkt, da die Hydroxid-Ionen eine geringere Leitfähigkeit besitzen als die Oxonium-Ionen.
Die pH-Kurve
Im Gegensatz zur Leitfähigkeits-Kurve, wo es nur um Tendenzen geht, werden die einzelnen pH-Werte bei der pH-Kurve hinterfragt, so z.B. der pH-Wert 1 am Beginn der Kurve oder der pH-Wert nach Zugabe des doppelten Volumens an Natronlauge, das man bis zum Äquivalenzpunkt benötigt hat (hier ca. 20 ml).
Die pH-Elektrode reagiert spezifische auf Oxoniumionen, für alle anderen Ionen ist sie blind. Durch Zugabe von Natronlauge nimmt die Konzentration von Oxonium-Ionen durch Neutralisation ab.
Durch die logarithmische Darstellung des pH-Wertes steigt die Kurve, wenn man sich dem Äquivalenzpunkt nähert und die Oxoniumionen-Konzentration immer geringer wird, sprunghaft an.
Jeder Punkt auf der Titrationskurve entspricht einem Tropfen. Im Sprungbereich erkennt man, dass nur durch wenige Tropfen der pH-Wert extrem ansteigt.
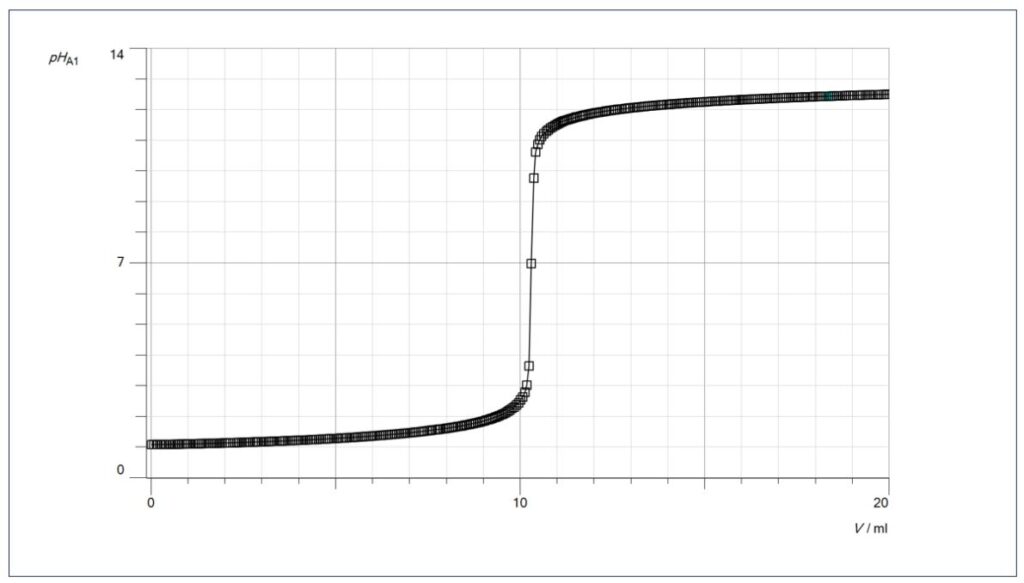
Aus der Titration mit einem Indikator ist dieses Phänomen bekannt, dort reicht ein Tropfen aus, um den Indikator zum Umschlag zu bringen.
Endpunktbestimmung
Wie erkennt man nun den Endpunkt, d. h. den Äquivalenzpunkt, bei einer Titration?
Wenn die pH-Elektrode neu ist und genau misst, muss der Endpunkt bei einer starken Säure, die mit einer starken Base titriert wird, immer bei pH 7 liegen.
Eindeutig ist der Endpunkt bei der Leitfähigkeitstitration zu erkennen. Durch Überlagerung der beiden Kurven wird bestätigt, dass der Äquivalenzpunkt in der Mitte des Sprungbereichs liegt.
Der Endpunkt lässt sich aber auch mathematisch durch die 1. Ableitung berechnen (im Diagramm als f1 bezeichnet): Dort, wo die Differenz zwischen den pH-Messwerten (geteilt durch die Differenz der Volumenmesswerte) am größten ist, befindet sich der Endpunkt.
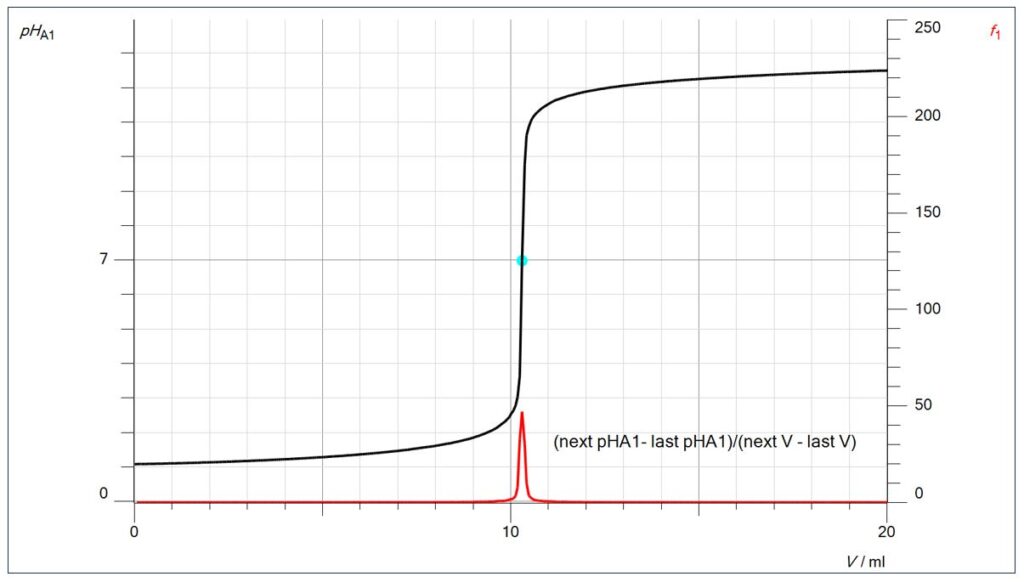
Die Formel für die 1. Ableitung kann über den Rechner/Neue Formel im Programm CASSY Lab 2 nach der Messwertaufnahme eingegeben werden, in diesem Fall lautet sie:
(next pHA1- last pHA1)/(next V – last V)
Mit pHA1 ist intern der linke Steckplatz auf dem Mobile CASSY bezeichnet, V ist das berechnete Volumen. Mit den Begriffen „next“ und „last“ wird auf Messwerte in der Messwertetabelle zurückgegriffen, so dass vom nachfolgenden Messwert der davorstehende abgezogen wird.
Dort, wo der pH-Sprung pro Volumendifferenz am größten ist, ist die 1. Ableitung am größten.
Über die Funktion „Darstellungen“ können in CASSY Lab 2 beliebig gemessene oder berechnete Größen in ein Diagramm gelegt werden. Dies soll mit folgendem Diagramm beispielhaft dargestellt werden, bei dem die Leitfähigkeits-Kurve mit der 1. Ableitung der pH-Kurve kombiniert ist:
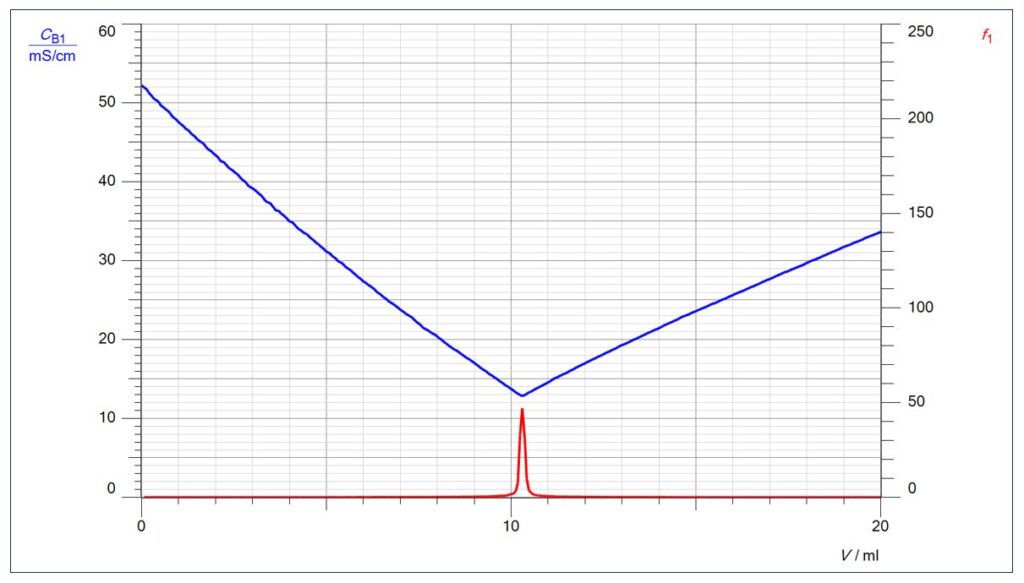
Natürlich zeigt der Peak der 1. Ableitung auf den tiefsten Punkt der Leitfähigkeits-Kurve, dem Wendepunkt der Leitfähigkeits-Titrationskurve.