
Jetzt schon im Lehrplan der 8. Klasse an bayerischen Gymnasien
Stöchiometrisches Rechnen ist von der Mathematik nicht kompliziert, da hier aber chemische und mathematische Techniken kombiniert werden, war es schon immer eine Herausforderung für Schüler. Und wird es auch im Gymnasium mit 9 Schuljahren (G 9) bleiben (im Lehrplan davor war das Chemische Rechnen erst Thema der 9. Jahrgangsstufe).
Vom Lehrplan sollen diese Inhalte an einfachen molekularen Verbindungen her abgeleitet werden, deren Zusammensetzung der Schüler bereits kennt (H2O, CH4, C3H8).
Lehrplan 8. Klasse Chemie Bayerisches Gymnasium G9
Wird z. B. Propangas verbrannt, kann man nur berechnen, wieviel Kohlenstoffdioxid und Wasser entsteht, leider nicht im Experiment mit einfachen Mitteln überprüfen.
Ich möchte an dieser Stelle ein Experiment vorschlagen (Bildung von Silbersulfid), bei dem sich über eine einfache Wägung sehr leicht die Berechungen, wie viel Silbersulfid entstehen sollte, nachprüfen lässt.
Im Lehrplan ist dieses Experiment an dieser Stelle nicht vorgesehen, da Salze (Silbersulfid) erst viel später im Lehrplan behandelt werden. Man kann daher die Formel von Silbersulfid (Ag2S) nicht erklären, sondern muss sie als gegeben hinnehmen.
Silber reagiert mit Schwefel zu Silbersulfid
Die Reaktion lässt sich stöchiometrisch im Experiment umsetzen, zum Überprüfen ist eine Waage mit der Genauigkeit auf vier Stellen notwendig.
Silber wird als Blech mit einer Masse von etwa 0,3 – 0,4 g verwendet, Schwefel im Überschuss zugesetzt. Wird das Experiment in der Schülerübung durchgeführt, werden die Werte in eine Excel-Tabelle eingetragen.
Sowohl das Edukt als auch das Produkt sind Feststoffe, die für eine Wägung hervorragend geeignet sind. Das Eintreten der Reaktion ist sofort erkennbar, das entstehende Silbersulfid ist nicht nur oberflächlich, sondern durch und durch. Dies wird durch die Wägung bestätigt.
Quantitative Auswertung
Die Abbildung zeigt eine Wertetabelle aus Excel mit 7 Versuchsdurchgängen, die während einer Schülerübung ermittelt wurden.
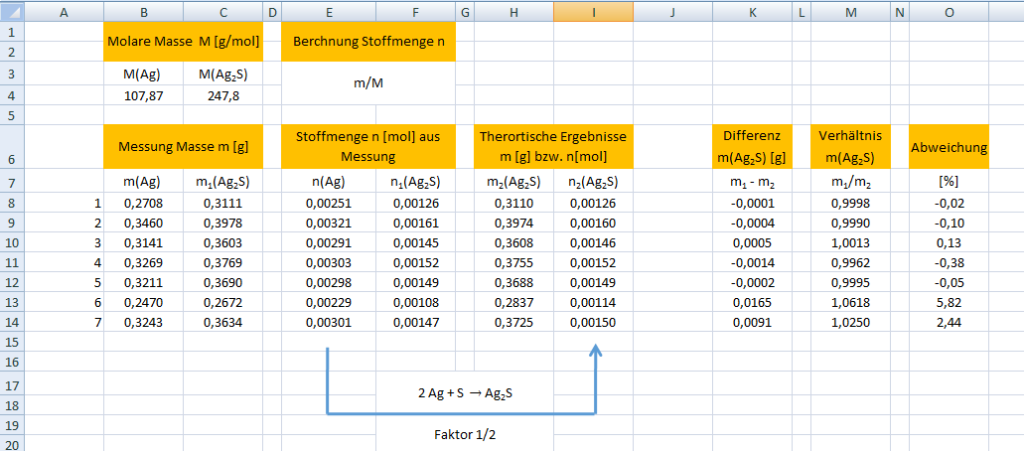
Excel_Tabelle zum Herunterladen
Aus der Reaktionsgleichung lässt sich ableiten, dass Silber und Silbersulfid im Verhältnis 2 zu 1 stehen und die Stoffmengen durch den Faktor 1/2 umgerechnet werden.
Aus 2 mol Silber entsteht durch Multiplikation mit 1/2 1 mol Silbersulfid.
Motto: Aus 2 mach 1
Vergleicht man die theoretische Ausbeute mit den experimentell ermittelten Werten, so überzeugt der Versuch durch seine Genauigkeit.
Die letzten zwei Versuchsdurchgänge sind Ausreißer, Silbersulfid ist im Gegensatz zu Silber brüchig, so dass bei unvorsichtiger Handhabe etwas verloren gehen kann.
Die Molbrücke
Das Verhältnis, abgeleitet aus den Koeffizienten der Reaktionsgleichung, (hier 2: 1 und der daraus abgeleitete Faktor 1/2) gilt nur für die Stoffmengen.
Schnell wird aus der Tabelle ersichtlich, dass die Masse nicht um die Hälfte abnimmt, wenn Silber zu Silbersulfid reagiert. Natürlich nimmt die Masse zu, da aus Silber und Schwefel ein neuer Stoff entsteht.
Stöchiometrische Rechnungen müssen immer über das Mol gehen, dies wird in der amerikanischen Literatur als Molbrücke bezeichnet.
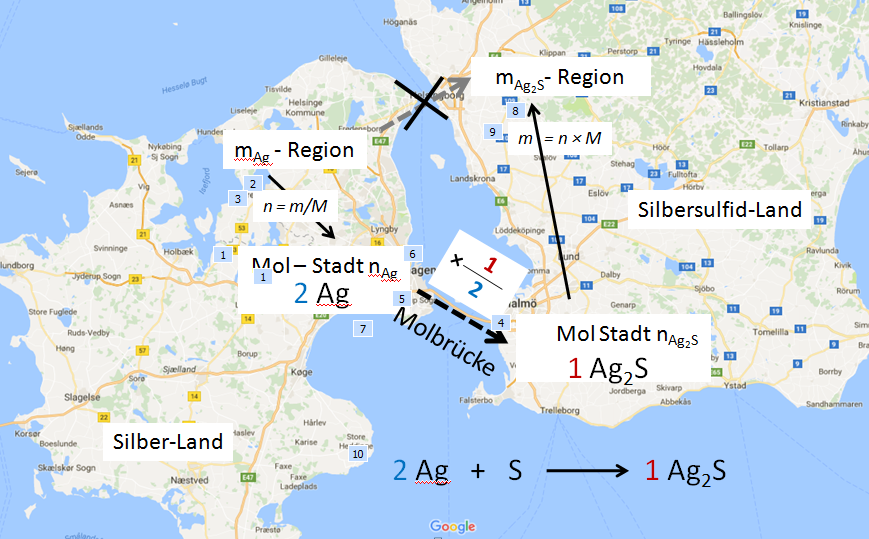
PPP: Bild Molbrücke
Vielfältig einsetzbarer Versuch
Der Versuch kann vielfältig genutzt werden: Er kann dazu benutzt werden, die Stoffänderung bei einer chemischen Reaktion zu zeigen (typischer Silberglanz, elektrische Leitfähigkeit und Duktilität des Silbers gehen verloren), aus dem Silbersulfid wird bei großer Hitze wieder Silber zurückgewonnen werden.
Eine Versuchsanleitung zu diesem Versuch kann heruntergeladen werden:
Silber - Silbersulfid
Mit der quantitativen Auswertung durch einer Excel-Tabelle lernt man viele Techniken, um mit Excel zu arbeiten.

